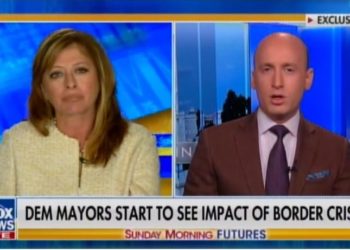
Remdesivir-Flaschen mit einer Spritze zur Behandlung von Covid-19 (Getty Images)
Die Food and Drug Administration hat am Montag ihre vollständige Genehmigung für die antivirale COVID-19-Behandlung Veklury (Remdesivir) für Säuglinge und Kleinkinder erteilt. Die Behandlung war zuvor unter Notfallgenehmigung für Kinder.
Laut der Pressemitteilung würde die FDA die Behandlung von Remdesivir auf pädiatrische Patienten im Alter von 28 Tagen und älter mit einem Gewicht von mindestens 3 Kilogramm (ca hohes Risiko einer schweren Erkrankung.
Werbung – die Geschichte geht unten weiter
Mehr von der FDA lesen Sie hier und unten:
Diese Maßnahme macht Veklury zur ersten zugelassenen COVID-19-Behandlung für Kinder unter 12 Jahren. Als Ergebnis der heutigen Zulassungsmaßnahme widerrief die Behörde auch die Notfallzulassung für Veklury, die zuvor diese pädiatrische Population abdeckte.
Bisher war Veklury nur zur Behandlung bestimmter Erwachsener und pädiatrischer Patienten (12 Jahre und älter, die mindestens 40 Kilogramm wiegen, was etwa 88 Pfund entspricht) mit COVID-19 zugelassen.
„Da COVID-19 bei Kindern schwere Erkrankungen verursachen kann, von denen einige derzeit keine Impfoption haben, besteht weiterhin ein Bedarf an sicheren und wirksamen COVID-19-Behandlungsoptionen für diese Bevölkerungsgruppe“, sagte Patrizia Cavazzoni, MD, Direktorin des Center for Drug Evaluation and Research der FDA. „Die heutige Zulassung des ersten COVID-19-Therapeutikums für diese Population zeigt das Engagement der Agentur für diesen Bedarf.“
Werbung – die Geschichte geht unten weiter
Veklury ist kein Ersatz für eine Impfung bei Personen, für die eine COVID-19-Impfung und Auffrischungsdosen empfohlen werden. Die FDA hat zwei Impfstoffe zugelassen, und drei Impfstoffe sind für den Notfall verfügbar, um COVID-19 und die schwerwiegenden klinischen Folgen im Zusammenhang mit COVID-19, einschließlich Krankenhausaufenthalt und Tod, zu verhindern. Die FDA fordert die Öffentlichkeit dringend auf, sich impfen zu lassen und bei Bedarf eine Auffrischungsimpfung zu erhalten. Erfahren Sie mehr über von der FDA zugelassene und autorisierte COVID-19-Impfstoffe.
Angesichts des ähnlichen Verlaufs der COVID-19-Erkrankung bei Erwachsenen und pädiatrischen Patienten wird die heutige Zulassung von Veklury bei bestimmten pädiatrischen Patienten durch Wirksamkeitsergebnisse aus klinischen Phase-3-Studien bei Erwachsenen gestützt. Informationen zu den Studien an Erwachsenen finden Sie in der von der FDA genehmigten Arzneimittelkennzeichnung für Veklury. Diese Zulassung wird auch durch eine einarmige, offene klinische Phase-2/3-Studie mit 53 pädiatrischen Patienten im Alter von mindestens 28 Tagen und einem Gewicht von mindestens 3 Kilogramm (etwa 7 Pfund) mit bestätigter SARS-CoV-2-Infektion gestützt und leichtes, mittelschweres oder schweres COVID-19. Patienten in dieser pädiatrischen Phase-2/3-Studie erhielten Veklury für bis zu 10 Tage. Die Sicherheits- und pharmakokinetischen Ergebnisse der Phase-2/3-Studie bei pädiatrischen Probanden waren ähnlich denen bei Erwachsenen.
Die einzige zugelassene Darreichungsform ist Veklury zur Injektion.
Zu den möglichen Nebenwirkungen der Anwendung von Veklury gehören erhöhte Werte von Leberenzymen, die ein Zeichen für eine Leberschädigung sein können; und allergische Reaktionen, die Veränderungen des Blutdrucks und der Herzfrequenz, niedriger Sauerstoffgehalt im Blut, Fieber, Kurzatmigkeit, Keuchen, Schwellungen (z. B. Lippen, um die Augen, unter der Haut), Hautausschlag, Übelkeit, Schwitzen oder Zittern umfassen können.
Die FDA hat Gilead Sciences Inc. die Zulassung erteilt.